Prof. Estela R. Domínguez*, Prof. David A. Apaza**
RESUMEN
La coartación de aorta es una cardiopatía de carácter obstructivo que compromete el flujo sistémico; este depende de la permeabilidad del ductus arterioso. El conocimiento de la fisiopatología, el tratamiento y las intervenciones de enfermería permiten planificar los cuidados e incidir sobre la morbimortalidad. En este artículo se identifican las características de esta patología y se presentan las principales intervenciones de enfermería a través de la revisión de diversos artículos y textos científicos.
Palabras clave: cardiopatías congénitas, coartación de aorta, cuidados de enfermería.
ABSTRACT
Coarctation of the aorta is an obstructive heart disea-se that compromises systemic flow; it depends on the patency of the ductus arteriosus. Knowledge of the pathophysiology, treatment and nursing interventions allow planning care and influencing morbidity and mortality. This article identifies the characteristics of this pathology and presents the main nursing interventions through the review of various articles and scientific texts.
Palabras clave: congenital heart disease, coarctation of the aorta, nursing care.
Cómo citar:
Domínguez ER, Apaza DA. Cardiopatías congénitas en el recién nacido: coartación de aorta. Rev Enferm Neonatal. Agosto 2021;36:6-17.
DESARROLLO
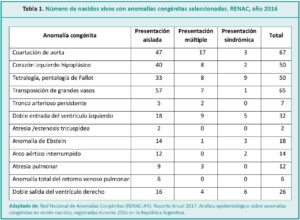
Las anomalías o defectos congénitos afectan a 3 de cada 100 recién nacidos (RN). Las anomalías congénitas estructurales, como las cardiopatías congénitas (CC), son aquellas que involucran alteraciones morfológicas y afectan tejidos, órganos o conjunto de órganos.1 Aproximadamente el 1 % de los RN presentan una cardiopatía (Tabla 1). En Argentina nacen al año unos 7000 niños con esta patología.2,3
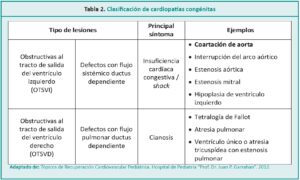
Las CC se pueden clasificar, en forma práctica y desde su fisiopatología, en dos grupos: defectos en los cuales la circulación pulmonar es ductus dependiente y defectos en los cuales la circulación sistémica es ductus dependiente (Tabla 2).4
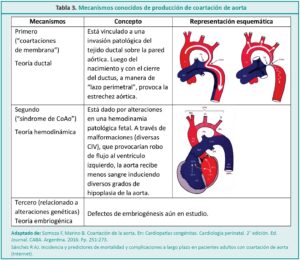
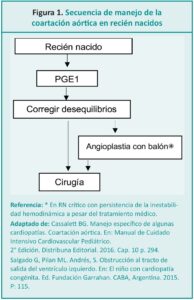
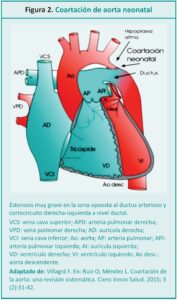
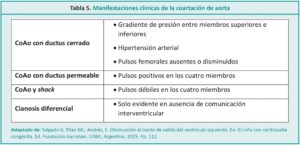
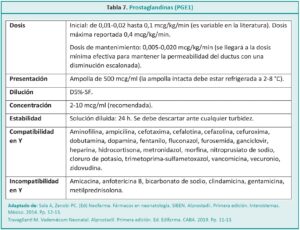
La coartación aórtica o coartación de la aorta (CoAo) se define como el estrechamiento localizado en la luz de la arteria aorta descendente (Figura 1), habitualmente a nivel de la zona de emergencia ductal, que causa una disminución del flujo aórtico y de la perfusión distal.5,6 Se produce por una hipertrofia de la capa media de la porción posterior del vaso que protruye hacia el interior y reduce la luz.7 En el RN las manifestaciones de la coartación dependerán de la velocidad de caída de las resistencias vasculares pulmonares y del momento del cierre fisiológico del ductus.8 Representa el 8-10 % de las cardiopatías congénitas y se asocia frecuentemente con el síndrome de Turner.9-11
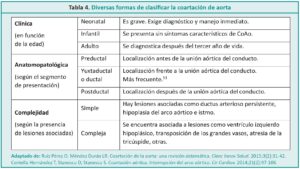
Esta patología puede presentarse en forma aislada o asociada a otras cardiopatías como ductus arterioso persistente, comunicación interventricular, estenosis de la válvula aórtica o subvalvular y a variadas formas de estenosis mitral.10,12 En general tiene múltiples formas de presentación con un amplio espectro de variedades anatomopatológicas.13
Los datos de la Red Nacional de Anomalías Congénitas (RENAC-AR) en su informe anual 2017 registra una prevalencia de 1,54 cada 10 000 nacidos vivos; ocupa el segundo lugar después de la transposición de grandes vasos (1,87) entre las cardiopatías comunicadas.14